核与化学损伤/神经性毒剂的中毒机理
神经性毒剂对机体的作用主要有三个面:一是选择性抑制胆碱酯酶活性,使乙酰胆碱(Ach)在体内蓄积,引起胆碱能神经系统功能紊乱;二是毒剂作用于胆碱能受体;三是毒剂对非胆碱能神经系统的作用。
一、对胆碱酯酶的抑制作用
胆碱酯酶根据其水解基质的专一性和速度不同分真性胆碱酯酶和假性胆碱酯酶,前者又称乙酰胆碱酯酶(AchE),后者包括丁酰胆碱酯酶(BuchE)和丙酰胆碱酯酶(PrchE)。
真性胆碱酯酶与胆碱能神经的生理功能极为密切。它主要存在于神经细胞、神经肌肉接头、红细胞及电鱼的电器官等部位。其生理功能是,当神经冲动到达胆碱能神经末梢时,突触小泡内的Ach外排至突触间隙,作用于突触后膜的胆碱能受体,引起下一级神经元或效应器的激发。在正常生理条件下,Ach完成传递冲动作用后,随即被突触后膜上的AchE在数毫秒内水解,生成乙酸和胆碱。此一水解过程分两步进行:即与Ach形成乙酰酶,然后乙酰酶脱乙酰基,酶恢复原有活性。
乙酰胆碱酯酶的活性状态是维持神经系统正常功能的重要条件,当AchE活性受到抑制时,就会导致一系列的神经功能紊乱。
(一)神经性毒剂对AchE的抑制机理
神经性毒剂特别是V类毒剂,对AchE的抑制作用与酶催化水解Ach的过程非常相似,神经性毒剂分子中含有亲电子的正磷原子(Pδ+),它与Ach分子中的正碳原子(Cδ+)同样具有亲电子性质。但神经性毒剂的亲电子能力此Ach强,这是因为毒剂分子中,P=O和P-F键上的O、F原子相对电负性比P原子大得多(相对电负性P=2.1,O=3.5,F=4.0,C&S=2.5)。因此,相对电负性大的O、F原子吸收电子成为负极,使P成为低电子密度的正极,即P原子带有较多的正电荷和更强的亲电子能力。所以神经性毒剂对AchE有更大的亲和力和抑制力。
神经性毒剂抑制AchE的过程如图12-2所示,G类毒剂的离开基团是短链的酸性基团F或-CN,无胆碱类似结构。因此,G类毒剂与AchE的结合不涉及负性部位。由毒剂分子中亲电子的正磷原子与被活化的丝氨酸羟基氧原子以共价键相结合,同时酯解部位的酸基提供一个质子(H+)给离开基团-F或-CN,并使之脱落,从而形成稳定的膦酰酶(phosphorylated enzyme),此一过程称酶的膦酰化(phosphorylation),见图12-2A。
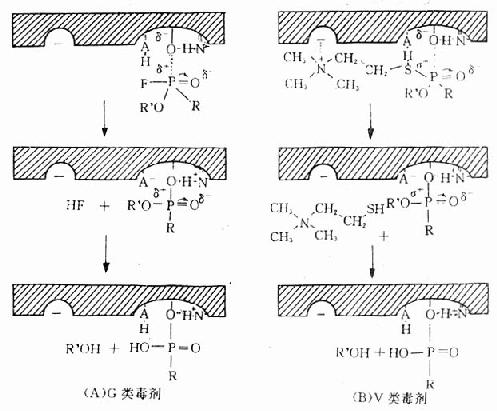
图12-2 神经性毒剂与AchE作用示意图
V类毒剂抑制AchE的过程与酶对Ach的作用非常相似。V类毒剂的离开的基团近似于Ach中的胆碱部分,依靠疏水性吸附和(或)静电引力与负性部位结合,毒剂的磷酰基与酯解部位结合,在羧基和碱基协同作用下,P-S键断裂,Pδ+与丝氨酸Oδ+形成共价键,产生稳定的膦酰酶(图12-2B)。
G类和V类神经毒与AchE结合形成的膦酰酶非常稳定,一般无自发水解作用。故称此类毒剂为不可逆性胆碱酯酶抑制剂。
另一类药物,如氨基甲酸酯类化合物的新斯的明、吡啶斯的明、毒扁豆碱等为可逆性胆碱酯酶抑制剂,分子结构中均含一氨基甲酰基和一季铵氮(毒扁豆碱为叔胺)。与酶作用时,首先氨基甲酸酯中的季铵氮阳离子头定位于酶的负性部位,氨基甲酰基则与酯解部位中的丝氨酸羟基氧结合,酯键断裂后形成氨基甲酰酶(carbamylated enzyme)。此一过程称酶的氨基甲酰化(carbamylation)。酶氨基甲酰化后即阻止乙酰化酶的形成,因此它也能使AchE失去水解Ach的能力,从而呈现一定的毒性作用。不过氨基甲酰酶可以自发水解,脱去氨基甲酰基后,酶即自行恢复。因此,当体内一部分AchE氨基甲酰化后,酶即被“保护”起来,从而避免神经性毒剂对它的攻击。这就是氨基甲酸酯类药物用着酶保护剂的基本原理。
综上所述,膦酰酶、氨基甲酰酶和乙酰酶三种酰化酶自动恢复酶活性的速度完全不同。膦酰酶是酰化酶中自动恢复活性最慢的一种,氨基甲酰酶次之,乙酰酶最快。这三种酰化酶自发半活性恢复期(t1/2)分别为:数小时至数天;数分钟;数毫秒。
由此可见,神经性毒剂严重中毒时,依靠酶活性的自动恢复很难解救严重中毒的病人。
(二)膦酰酶的转归
神经性毒剂与AchE形成的膦酰酶并非是完全不可逆的,也不是反应的终止。随着时间和条件的改变,膦酰酶可以继续发生质和量的变化。这些变化有:酶活性的自动恢复;酶老化和在重活化的剂的作用下发生重活化(图12-3)。
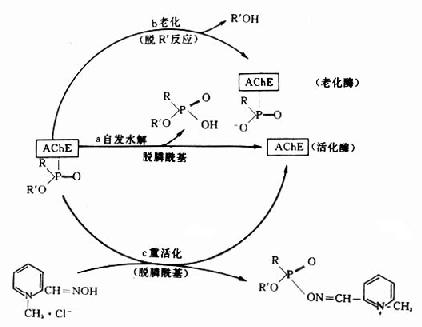
图12-3 膦酰酶的转归
1.自动恢复酶活性:酶活性的自动恢复是由弱亲核试剂水分子的阴离子OH-与膦酰酶中膦酰基的Pδ+发生亲核反应,使酶与膦酰基间的共价键断裂,从而使膦酰基从酶分子上水解下来(图12-3a)。根据毒剂结构不同,各种神经性毒剂与酶形成的膦酰酶,其自动恢复速率有很大差别。有的恢复较快(如VX),有的恢复较慢(如GB),有的几乎不能恢复(如GD)。
2.膦酰酶老化:膦酰酶经一定时间后,烷氧基上的烷基(R')发生脱落,即脱落烷基反应(deakylation)。脱落R'后的膦酰酶就失去了重活化的能力。中毒酶从能被重活化的状态转变为不能被重活化的状态,这一过程叫酶“老化”(aging)。老化的实质是中毒酶负性部位带质子的酸(H+)和膦酰氧形成氨键,促使烷氧键(R'-O)断裂,于是烷基(R')脱落(图12-3b)。
不同中毒酶的老化速度取决于毒剂的种类。梭曼中毒酶老化速度最快,而且几乎无自动恢复现象;VX中毒酶不仅自动恢复快,老化也很慢(表12-4),这主要与毒剂的烷氧基结构有关(烷氧基的α及β碳原子无取代基,不易老化,如VX中毒酶;被甲基取代后则易老化,如沙林中毒酶;甲基数愈多,老化愈快,如梭曼中毒酶)。
表12-4 神经性毒剂中毒酶的自动恢复和老化速度*
|
毒剂种类 |
24h自动恢复(%) |
半老化期(h) |
|
VX |
~70 |
60 |
|
塔崩 |
- |
31 |
|
沙林 |
4 |
12 |
|
梭曼 |
0 |
<0.04 |
*酶原:人红细胞,25℃,pH7.1~7.3
老化酶一经形成,非但不能自行水解,自动恢复酶活性,而且也失去酶重活化剂对其重活化的作用。老化酶不能重活化,原因之一是烷基(R')脱落后,老化酶的P原子正电性降低,与带负电的肟基(=NO-)亲和力也随之降低;此外,老化酶带负电的羟基氧(![]() )与带负电的肟基具有相互排斥作用,进一步影响肟基与P原子的结合。
)与带负电的肟基具有相互排斥作用,进一步影响肟基与P原子的结合。
梭曼的烷氧基较大,能遮盖酶的负性部位,造成空间障碍。在使用酶重活化剂时,硕大的烷氧基能阻碍重活化剂与酶的负性部位结合,这也是梭曼中毒酶难以重活化和重活化剂对梭曼中毒疗效较差的原因之一。
3.膦酰酶重活化:应用重活化的剂使膦酰基从酶的结合部脱落下来,恢复酶活性已得到实际应用。目前常用的重活化剂多为肟类化合物(oximes),如氯磷定、双复磷、甲磺磷定、双磷定等。其分子结构中均含有肟基和季铵氮,它们能大大加速脱膦酰基反应的速度,加速酶的活性恢复(图12-3c、图12-4)。反应原理是:

图12-4 氯磷定对中毒酶重活化示意图
(1)首先,肟类药物(如氯磷定)分子中季铵氮借静电引力结合在酶的负性部位,从而使整个分子固定在最有利于向Pδ+原子攻击的位置图(12-4a)。
(3)负性肟基(=NO-)对中毒酶的Pδ+原子进行亲核性攻击,形成膦酰肟并离开酶的活性表面,于是酶恢复为原来状态。(图12-4c)。
应当知道,同一种重活化剂对不同中毒酶的重活化作用强度不同的,不同的重活化剂对同一中毒酶重活化作用的相对强度也不一样。例如氯磷定对沙林中毒酶的重活化率高于对塔崩中毒酶的重活化率;双复磷对塔崩中毒酶的重活化效果优于氯磷定。
综上所述,神经性毒剂能使AchE失去水解Ach的能力。在突触部位,AchE的抑制,引起突触后Ach的蓄积和对受体的持续作用是导致胆碱能神经系统功能紊乱的重要原因。动物实验和临床中毒病人中均已证明有机磷毒剂中毒时,血液和脑组织中Ach含量均有升高,而且AchE抑制程度、Ach含量增加与中毒剂量有着平行关系。重活化剂可使酶的活性重新恢复,但在实际应用时要注意不同中毒酶的老化速度和对不同毒剂中毒采用不同的重活化剂,参见表12-5。
表12-5 几种肟类重活化剂的抗毒效果比效
|
重活化剂 |
塔崩 |
梭曼 |
沙林 |
VX |
|
2-PAM-CL |
0 |
0 |
+ |
+ |
|
TMB-4 |
++ |
- |
++ |
++ |
|
LüH-6 |
+ |
- |
++ |
++ |
|
HI-6 |
0 |
+ |
++ |
+++ |
注:- 相反作用;0 无效;+ 效果好;++ 效果很好;+++ 效果极好
塔崩是目前唯一确证在战争中大规模使用的神经性毒剂,其抑制酶的能力弱于沙林、梭曼和VX。塔崩中毒酶无自动重活化作用,老化速度比沙林、梭曼等中毒酶慢得多,故老化在塔崩中毒救治过程中不占重要地位。双吡啶肟类药物中仅4位肟基的化合物对其抑制的酶有一定的重活化作用,其中以TMB-4重活化作用最强,LüH-6次,研制的三种4位肟基的H系药物均较弱;单吡啶肟类中,仅2位肟基的芐基单吡啶醛肟对塔崩中毒酶有较强的重活化作用,PAM类的重活化作用均较弱(罗春元博士论文,1993)。
二、对胆硷能受体的作用
(一)通过Ach对受体的间接作用
1.胆碱能受体:早先,蛙心灌注实验证明Ach是一种神经介质,它在体内与受体结合产生作用。已有几种方法可以分离这种受体,并证明它们是位于细胞膜上的蛋白质。经分离测得溶解状态的胆碱能受体蛋白质分子量为42000,它由数个亚单位构成,但对这些亚单位结构类型还有不同的看法,因此受体有不同的分子量。经推算,骨骼肌的单条纤维上平均有4.7×107个受体,每个运动终板上平均有3×106~3×107个受体。根据放射性箭毒结合受体的位点数目,推算受体的全部表面积还不到终板表面积的1%。当一个生理效应产生的时,仅是其中的一小部分受体发生兴奋。实验证明,阻断50%的胆碱能受体不会影响生理功能,阻断70%时,功能才会受到明显影响。
乙酰胆碱受体分两类,即毒蕈碱样乙酰胆碱受体(M-AchR,简称M受体)和烟碱样乙酰胆碱受体(N-AchR,简称N受体)。
(1)毒蕈碱样乙酰胆碱受体:该受体能为Ach所兴奋,也能为毒蕈碱所激动。类似作用激动剂有毛果芸香碱、槟榔碱、氧化震颤素等。M受体主要分布在外周副交感节后纤维所支配的平滑肌和腺体包括汗腺上;在中枢则主要分布于大脑皮层锥体细胞。其典型特点是可被阿托品及其同类化合物东莨菪碱、樟柳碱及二苯羟乙酸-3-喹咛环酯所阻断。
(2)烟碱样乙酰胆碱受体:也能被Ach所兴奋,同样也可被低浓度烟碱所激动(高浓度被阻断)。N受体主要分布在骨骼肌的神经肌肉接头、植物神经节和肾上腺髓质等突触后膜上。在中枢主要分布于脊髓闰绍氏细胞。据此可分为神经节型(N1-AchR)和神经肌肉接头型(N2-AchR)两种亚型。故其阻断剂或拮抗剂分神经节和神经肌肉接头两类:前者有美加明、五烃季铵、六烃季铵;后者有十烃季铵、d-筒箭毒、a-银环蛇毒、眼镜蛇毒等。
在中枢神经系统,M和N两种受体均存在,甚至同一细胞上有两种受体,而以一种占优势。大脑皮层锥体细胞则以M受体为主,脊髓闰绍氏细胞则以N受体为主。丘脑的神经元则为混合型。
2.乙酰胆碱与受体的结合方式:胆碱能受体的分子构图(topography)与AchE有相似之处,但又不完全相同。如M受体有两个活性中心(负性部位、亲酯部位)和疏水区。当Ach与受体接近时发生①Ach的季铵氮与受体分子的负性部位以静电引力和范德华引力相互结合;②受体上带部分正电荷(δ+)的基团以氢键方式与Ach的醚氧结合;③另一带正电荷基团与Ach羰基氧相互作用;④亲酯部位附近的疏水区与Ach的甲基以范德华引力相吸引(图12-5)。
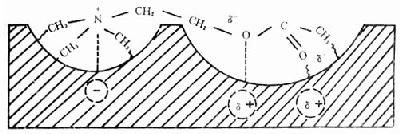
图12-5 Ach通过静电、偶极和疏水性相互作用与受体结合
除上述三个部位外,可能还有一个未定部位,它主要与M抗胆碱药物的羟基结合。还有人认为M受体的亲酯部位有两个带电荷相反的基团,一是带部分负电荷的基团,另一是带部分正电荷的基团。
N受体的活性中心也由三个部位组成,第一是负性部位,这是最主要的,带有完整的负电荷,它与烟碱样物质或Ach的阳离子头结合;其次是带部分负电荷的亲酯部位,主要与Ach的酯基部位结合(静电吸引),第三是辅助阴离子部位,此部位不与Ach发生作用,但能与双季铵类化合物的第二个季铵阳离子头以离子键方式结合。
Ach与受体结合后,引起受体分子立体构型改变,进而激起细胞内氧化磷酸化和细胞膜对Na+、K+等离子通透性改变,从而引起一系列生理效应。
(二)毒剂对受体的直接作用
神经性毒剂抑制酶活性,Ach在突触处积聚并作用于胆碱能受体,引起一系列神经功能紊乱,这是毒剂的间接作用,是导致中毒的主要原因。但也发现许多与此相矛盾的现象:如酶活性抑制程度与临床表现并非完全一致;事先用酶抑制剂将某些离体器官的AchE活性完全抑制,然后再次或重复应用毒剂,仍能引起毒性效应。还有,中毒动物毒性症状消失与酶活性恢复不成平行关系等。这些事实说明,毒剂除对AchE有抑制作用外,可能对受体还有直接作用。如梭曼、VX、沙林、塔崩与大鼠心肌M2受体有很高的亲和力,它们结合在M2受体Ach结合部位上能够抑制[3H]CD(一种与M2受体有很高亲和力的化合物)与M2受体的结合;二苯羟乙酸-3-喹咛环酯(QNB)作为配体,能与M受体产生物异性结合,大鼠梭曼中毒后,皮层、海马M受体与[3H]QNB结合数则明显减少,从而表明梭曼也能与M受体直接结合。此外,VX与N受体的直接结合,国内也有报道。神经性毒剂对周围神经节和神经肌肉接头也有影响,而且也是通过对受体的直接作用产生的。可是神经性毒剂对受体的直接作用所需剂量比抑制酶活性的剂量要大得多。因此,它在毒理作用中的实际意义如何,尚难断定。不过,受体在毒剂中毒发生和发展过程中在某些方面可能起重要作用。如毒剂引起的中枢神经性呼吸麻痹、血压下降、心律失常等与毒剂直接作用于呼吸中枢和相关受体有一定关系。此外,受体对中毒后重要器官功能的自动恢复也起着重要作用,这是因为受体在中毒过程中产生了脱敏效应和受体数目减少有关。
三、对非胆碱能系统的作用
在接近LD50剂量时,神经性毒剂能影响中枢非胆碱能系统的活动。如神经性毒剂中毒引起的中枢性惊厥和小脑环-磷酯鸟苷(cGMP)浓度的迅速升高,阿托品对之无效,而安定则可使惊厥消失以及cGMP浓度下降。γ-氨基丁酸(GABA)是一种与惊厥发生有关的重要物质,对中枢神经元普遍的抑制效应。实验表明梭曼引起的惊厥,原因是它能干扰GABA能受体对GABA的亲和力和利用率,而安定等苯并二氮杂卓类化合物则能增强受体对GABA的亲和力和利用率,故有抗惊作用。
此外,还观察到塔崩、沙林和梭曼还作用于腺苷酸环化酶和磷酸二酯酶导致脑内环—磷酸腺苷(cAMP)和cGMP含量的改变。
| |||||||||||