螯合作用
螯合作用(chelation),具有两个或两个以上配位原子的多齿配体与同一个金属离子形成螯合环的化学反应。具有多齿配体的化合物称为螯合剂,产物称为金属螯合物(或螯合物)。例如,乙二胺H2NCH2CH2NH2是一个双齿螯合剂,它的两个氮原子配位到同一金属离子上形成五原子螯合环的金属螯合物(图 1a)。
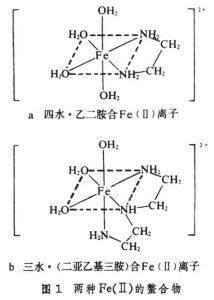
二亚乙基三胺H2NCH2CH2NHCH2CH2NH2是一个三齿螯合剂,它的三个氮原子可以同时配位到一个金属离子上(图1b)。螯合剂中配位原子的数目除了二齿、三齿外,还有四齿、五齿、六齿等。金属离子和螯合配体生成的螯合物,比它和单齿配体生成的类似配合物有较高的稳定性。
反应机理 配体和金属离子之间的配位键通常有两种类型:①配体上酸的基团离解去H+,然后与金属离子配位;②配体上含有孤电子对的中性基团与金属离子配位。如果配体上同时有两个基团与一个金属离子配位,不论是两个①型或者两个②型,或者①和②型兼有之,都能形成螯合环。几种螯合剂与金属离子形成螯合物时,草酸以两个①型(图2a),乙二胺以两个②型(图2b),甘氨酸以一个①型和一个②型(图2c),乙二胺四乙酸以四个①型和两个②型(图2d)配位。
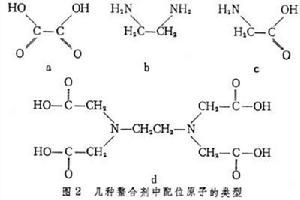
通常在配位原子上增强负电荷的定域化,就会增高它配位于金属离子的能力。①型是金属离子取代H+,与配体相配位。对于相类似的配体来说,增加配体的碱强度能增加它与金属的螯合能力。设 L-为螯合剂阴离子,Mn+为金属离子,K为质子化常数(酸离解常数的倒数),KML为金属螯合物的稳定常数,则
![]() (1)
(1)
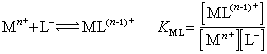 (2)
(2)
可见,K 是衡量L-亲H+能力的尺度,KML是衡量L-亲核(金属离子)能力的尺度,两者是统一的。实践证明,这两个常数有相当一致的平行关系。
金属螯合物 螯合物最显著的一种特性是其热力学稳定性和热稳定性。螯合环的稳定性与芳香环相似。例如,β-乙酰丙酮(醇式)失去一个H+以后,配位于金属离子M2+,所得六元环螯合物有较高的热稳定性[式(3)]:
但单齿配体丙酮的金属配合物是极不稳定的。决定螯合物稳定性的因素有三种。
金属离子 金属离子与配体形成螯合物的一般原则是软硬酸碱理论,就是:硬酸亲硬碱,软酸亲软碱(见配位化学)。在大多数螯合剂中,常见的配位原子是氮、氧和硫。在Li+、K+、Rb+、Cs+、Mg2+、Ca2+、Sr2+、Be2+、Al3+、Ga3+、In3+、Tl3+、Ti4+、Zr4+、Th4+、Si4+、Ge4+和Sn4+的大量螯合物中,至少有一个配位原子是氧,上述阳离子很少接受两个氮或一个硫配位。钒、铌、钽、钼、铀及Be2+、Fe3+和Al3+等基本上只接受氧配位,在特殊条件下才与氮、硫或磷配位。Cr3+、Fe2+及铂金属较易接受氮配位。Cu+、Zn2+、Ag+、Au+、Cu2+、Cd2+、Hg2+、V3+、Co3+和Ni2+ 明显地接受氮和硫为配位原子。
碱金属、碱土金属和稀土金属螯合物的稳定性,常随其阳离子电荷的减少、半径的增加而减少,这与一般配合物的性质一致。如碱土金属螯合物在螯合环相同时,其稳定性次序:Mg2+>Ca2+>Sr2+>Ba2+>Ra2+。
螯合物稳定性与离子半径的关系在有些情况下没有规律性,如第 1过渡周期金属元素螯合物稳定性次序:Zn2+<Cu2+>Ni2+>Co2+>Fe2+>Mn2+。
配体 配体上取代基的改变,对整个螯合物稳定性有影响。图中A为电子吸引基。随着A基电子吸引力的减弱,电荷从氮上被拉走的趋势减小,使得配体的碱强度和螯合能力都增加。下列A基的电子吸引力从左到右减弱:
,使图3所示螯合物的稳定性逐渐增高。
应用 由螯合作用得到的某些金属螯合剂用途很广。例如EDTA为六齿螯合剂,可用于水软化、锅炉水垢去除、工业清洗、食物保存等方面。氮三乙酸为廉价的四齿螯合剂,在有些工业中的应用已超过EDTA。用某些螯合剂制备生物体系的金属离子缓冲剂,可使某种金属离子浓度维持恒定和很低,例如,Ca2+-EDTA缓冲剂可用于研究血浆和脑匀浆。腐植酸是植物降解后在湖底的沉积物,它是天然水中良好的金属离子调节剂。生物体内的酶是复杂的生物金属螯合物,对生物的存在和生长起重大的作用,在不少酶分子中含有Fe2+、Zn2+、Mg2+、Co2+、Mo2+、Cu2+和Ca2+等金属。又如二巯基丙醇是砷、汞及某些重金属的解毒药。D-青霉胺毒性小,又有氧、氮、硫三种配位原子,是汞、铅和重金属的有效解毒剂。三聚磷酸盐已用作合成洗涤剂中的重要成分。此外,环状配体冠醚类对碱金属和碱土金属的分离和分析特别适用。
参考书目
J. E. Huheey, Inorganic Chemistry, Principles'of Structure and Reactivity, 3rd ed., Harper & International Science, Cambridge, 1983.