临床生物化学/酶活性测定条件的选择和限定
引言中已强调了仅在一定条件下酶反应速度v才和酶量成正比例。一定条件是什么?这些条件之间有无主次关系?如何选择合适的测定条件?这些都是实验室工作者在设计或选择测酶活性浓度方法时必须面对的问题。
首先可从理论上探讨在什么特定情况下的反应速度才可能与酶量成正比例。酶的整个反应过程可简化如下:
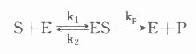
式中Kp可看成为ES的解离常数.Michaclis和Menten通过推导可得出下式方程式
![]()
此式中V为最大反应速度,对一定浓度的酶而言为一常数。Km为实验室工作所熟系的米氏常数。上式也可改写为:
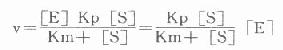
Kp和Km虽为常数,但[S]为变量,因此
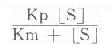 在一般情况下不可能为常数,即v≠k[E],从理论上很清楚说明反应速度v和酶量E之间在绝大多数条件下只存正比,即v∝[E]。而非正比例关系。但在底物[S]浓度很大,远远超过Km的特殊条件下Km值由于相对很小可忽略不计。此式可变为:
在一般情况下不可能为常数,即v≠k[E],从理论上很清楚说明反应速度v和酶量E之间在绝大多数条件下只存正比,即v∝[E]。而非正比例关系。但在底物[S]浓度很大,远远超过Km的特殊条件下Km值由于相对很小可忽略不计。此式可变为:
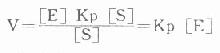
由于底物[S]浓度很大,使酶饱和。ES已达极限,反应速度不再增加,故此时反应速度为最大反应V。即从理论上说只有测定的是酶最大反应V。此时反应速度才和酶量E成正比例。也只有在此基础上建立起来的测定方法才是可靠的、准确的。
Kp是酶学中很重要的一个常数,即周转数(Turnover number),从上式可得出。

其含义为每分钟每分子酶转换底物分子数。酶的Kp数值约在50-105min-1之间。碳酸酐酶是目前已知最高酶变率的酶(36×10-6min-1)。Kp的倒数代表每一酶催化循环的时间,以碳酸酐酶为例
1/Kp=lmin/136×106=0.028×10-6min=1.7μs
即每隔1.7μs,一分子酶就和一个底物结合,反应一次。
国际临床化学联合会(IFCC)和不少国家包括我国的一些学会建立了或正在建立测定酶活性浓度的推荐或参考方法。都毫无例外地提出测酶活性浓度方法所选择的测定条件应是酶反应的“最适条件”以保证酶具有最大的催化活性。实质上就是基于以上理论考虑,要测定酶的最大反应速度V。
我国检验学会文件中对最适条件是这样提出:①选合适的底物、辅因子、活化剂、变构剂的种类和浓度。②指示酶和辅助酶的种类和浓度。③反应混合液的最适pH,缓冲液种类和浓度。④其它影响酶活性的因素,如去除各种抑制剂。并提出:在某些情况下,为了获得更好的测定重复性或更大的临床价值,可考虑对上述“最适条件”作适度的修改。