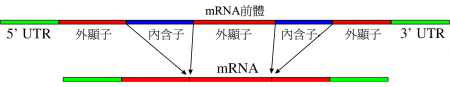
RNA剪接
剪接(英文名:Splicing,又称拼接),是一种基因重组技术,在分子生物学中是指基因资讯在转录后的一种修饰,即将内含子移除及合并外显子。是真核生物的信使RNA/信使RNA前体(precursor messenger RNA)变成成熟mRNA的过程之一。这也是真核生物与原核生物的区别之一(请参看顺反子)。这些成熟的mRNA会接着进行蛋白质生物合成中的翻译,以产生蛋白质,称转译作用。 剪接是核糖核酸(RNA)核苷酸之间的一连串生化反应,并由小核核糖蛋白(snRNP)中的snRNA负责催化并作用。也有一些类型不需外在催化物质,而是在特定二价金属离子存在的情况下,以自我催化方式进行剪接,如第I型或第II型内含子 (type-I or type-II intron)。
剪接途径
RNA剪接可以有多种的方式。剪接的型式以内含子的结构及剪接所需的剪接因子而定。此外,RNA剪接还分为分子内 (intramolecular) 剪接 (cis splicing) 以及分子间 (intermolecular) 剪接 (trans splicing)。但不论哪一种途径,移除的内含子都会被抛弃。
剪接体
内含子经常存在于真核生物的蛋白质编码基因(coding gene)中。在内含子里,需要有 5' 剪接位点(5' splice site)、3' 剪接位点(3' splice site)及剪接分枝位点(branch point)来进行剪接。剪接是由剪接体(Spliceosome)来催化,它是以五个不同的小核核糖核酸 (snRNs) 以及不下于一百个蛋白质所组成的大型核糖核酸蛋白质复合物,称为小核核糖蛋白(snRNP)。snRNP 的 RNA 会与内含子行杂交反应(hybridization),并且参与剪接的催化反应。
自剪接
模板:TransHint出现在稀少的内含子组成核酸酶,核酸酶在只有RNA的情况下代替了剪接体的功能。自剪接的内含子有两种,称为第I型及第Ⅱ型。第I型及第Ⅱ型内含子以与剪接体类似的方式进行剪接,但不需要任何蛋白质。这种相似性使人相信这些内含子与剪接体在演化过程上有着关连。自剪接亦可能是非常古老,且可能出现在一个还未有蛋白质的核糖核酸世界。虽然以下两种剪接可以在没有蛋白质的情况下进行,但依然会额外的使用5个RNA分子及超过50多个蛋白质,并水解多个三磷酸腺苷(ATP)分子。使用 ATP 是要提高剪接mRNA的准确性,避免出现错误。
以下两次转酯化是第I型内含子自剪接的特征:
- 游离鸟嘌呤核苷酸(被包在内含子中)的3'羟基,或是核苷酸辅助因子(即鸟苷单磷酸(GMP)、鸟苷二磷酸(GDP)、鸟苷三磷酸(GTP))攻击内含子的5'剪接位点。内含子并不形成套索结构,而该鸟粪苷则会从内含子中转移位置到内含子的5'位,从而成为第I型内含子的第一个核苷酸。
- 内含子5'剪接位点上游外显子最后一个核苷酸的3'羟基变成亲核基,而第二次交酯化/转酯化会将两个外显子接合。
以下是第Ⅱ型内含子自剪接的特征(与第I型相同是两次交酯化):
转运RNA剪接
转运RNA(tRNA)剪接是另一种较罕见的剪接方法,但是却经常在 tRNA 出现。它的剪接反应涉及与剪接体或自剪接不同的生物化学过程。核糖核酸酶切开RNA,而连接酶 (RNA ligase) 则将外显子接合。这种剪接方式同样不需要任何RNA分子来催化,而是一种全由蛋白质催化和作用的反应。整个过程中并未有交酯化/转酯化作用。
演化
在所有生物界或生物域中都有出现剪接,剪接的幅度及类型在主要的生物门中都可以非常不同。真核生物中RNA剪接好发于mRNA及一些非编码RNA。原核生物则很少剪接,但多是非编码RNA。两种生物最大的差异是原核生物没有剪接体剪接途径。
由于剪接体内含子并非在所有 生物种中得到保存,有人便因此质疑剪接体演化的起始点。现时有两种建议的模式:内含子先天存在理论及内含子后天衍生理论。生物化学过程
剪接体剪接及自剪接涉及两个步骤的生物化学过程。两个步骤均需要在RNA间进行转酯化反应。但是tRNA剪接则没有交醋化/转酯化过程。剪接体及自剪接交酯化反应的发生有特定的次序。首先,一个在内含子的特定“剪接分枝位点”核苷酸会与这个内含子的第一个核苷酸产生转酯化反应,形成两个RNA分子,一个是“内含子套索”另一个则是内含子前的外显子。第二,第一个外显子最后的核苷酸会与第二个外显子的首个核苷酸产生转酯化反应,连接外显子并释放内含子套索。
选择性剪接
在很多时候,剪接过程可以透过对同一个基因转录的相同pre-mRNA使用不同的剪接选择,产生不同的mRNA异构物(isoform),最后产生多种相似却又独特的蛋白质,或是产生出稳定性低的mRNA产物以达到调节基因表现的目的。而由于选择性剪接的存在而使基因组可以产生比基因子量还多许多倍的基因产物。
Pre-mRNA的剪接也并不是完美的。据估计,人体细胞中有约70%的基因会进行选择性剪接。而其中又有三分之二以上的剪接产物 (spliced transcripts) 因为剪接过程的不够精确、或是形成未成熟的终止密码子 (premature termination codon, PTC) 而造成该 RNA 的降解 (RAN degradation)[1]。另有研究显示,剪接过程中的交酯化/转酯化反应在特定条件下是可逆的[2]。这对于剪接反应如何维持或调结其精确性提供了新的思路,并对如何治疗因剪接错误而起的人类疾病提供了新方向。
剪接的实验处理
干扰 mRNA 剪接的实验可以透过将以吗啉基或肽核酸修饰之反义寡核苷酸结合在 snRNP 于 mRNA 上的结合位点、型成套索结的核苷酸分支点或剪接调控因子的结合位点上[3]来作出修改。[4][5]
另外,籍由影响剪接调控因子在细胞的正常表现,或是在试管反应中控制调控因子的相对浓度,甚至是剪接体的相对浓度都能达成对 mRNA 剪接干扰的目的。
剪接误差
内含子或外显子的突变可以阻碍剪接及从而影响蛋白质合成。一般的误差包括:
- 拼接位点的突变造成位点失去功能。这是因过早与终止密码子的接触、失去外显子、或包含内含子。
- 拼接位点附近的突变减少独特性。这可以是因拼接位置的差异,引发插入或移除胺基酸,或通常是失去阅读框架。
- 拼接位点的移位。这是因包含或排除比预期更多的DNA,造成较长或较短的混合外显子。
- 选择性剪接作用蛋白的影响。这些非剪接体的核糖核酸结合蛋白会影响剪接体对于剪接位点的选择。通常的作用是各式阅读框架的改变。
内部连结
参考
- ↑ Sorek R, Shamir R, Ast G. How prevalent is functional alternative splicing in the human genome?. Trends Genet. 2004, 20 (2): 68-71. PMID 14746986.
- ↑ Tseng CK, Cheng SC. Both Catalytic Steps of Nuclear Pre-mRNA Splicing Are Reversible. Science. 2008, 320 (5884): 2409-20. PMID 18583613.
- ↑ Bruno IG, Jin W, Cote GJ. Correction of aberrant FGFR1 alternative RNA splicing through targeting of intronic regulatory elements. Hum Mol Genet. 2004, 13 (20): 2409-20. PMID 15333583.
- ↑ Draper BW, Morcos PA, Kimmel CB. Inhibition of zebrafish fgf8 pre-mRNA splicing with morpholino oligos: A quantifiable method for gene knockdown. Genesis. 2001, 30 (3): 154-6. PMID 11477696.
- ↑ Sazani P, Kang SH, Maier MA, Wei C, Dillman J, Summerton J, Manoharan M, Kole R. Nuclear antisense effects of neutral, anionic and cationic oligonucleotide analogs. Nucleic Acids Res. 2001, 29 (19): 3965-74. PMID 11574678.
模板:Post transcriptional modification