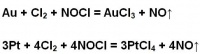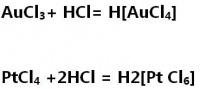王水
王水(aqua regia) 又称“王酸”“硝基盐酸”,是一种腐蚀性非常强、冒黄色烟的液体,是浓盐酸(HCl)和浓硝酸(HNO3)组成的混合物,其混合比例从名字中就能看出:王,三横一竖,故盐酸与硝酸的体积比为3:1。它是少数几种能够溶解金(Au)物质之一,这也是它名字的来源。王水一般用在蚀刻工艺和一些检测分析过程中,不过塑料之王——聚四氟乙烯和一些非常惰性的纯金属如钽(Ta)不受王水腐蚀(还有氯化银和硫酸钡等)。王水极易分解,有氯气的气味,因此必须现配现用。
一、历史
有两位科学家,劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水”(盐酸与硝酸混合液)中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵时,当时弗兰克工作的美国芝加哥市还专门举行了一个隆重的奖牌归还仪式。
二、原理
虽然王水的两个组成部分单一无法溶解金,但它们联合起来却可以溶解金,原理是这样的:硝酸是一种非常强烈的氧化剂,它可以溶解极微量的金,而盐酸则可以与溶液中的金离子反应,形成四氯合金酸(铂是生成了六氯合铂酸,简称氯铂酸),使金离子在氯离子的配位作用下减少,降低了金离子的电势,这样硝酸就可以进一步溶解金了。其实不是增强了硝酸氧化性,而是浓盐酸增强了金铂的还原性。
三、配法
取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻棒搅拌.看到溶液迅速变黄这是由于生成亚硝酰氯之故.容器壁微热 .没有过什么样的剧烈反应!
王水:需现配现用,王水可用来溶解许多金属和合金,其中包括钢、高温合金钢、铝合金、锑、铬和铂族金属等。王水和其他类似混合液在化学分析中用于溶解某些铁矿石、磷酸盐岩石、矿渣、镍铬合金、锑和硒以及不易溶解的汞、砷、钴和铅的硫化物。
植物体与废水也常使用它来进行消化。王水可从硅酸盐基质中酸洗出部分金属,但无法有效的加以完全溶解。
逆王水:也叫勒福特王水(Lefort),是三份硝酸与一份盐酸的混合物,可用来溶解氧化硫和黄铁矿。 危险,注意安全使用!!!!!
王水中含有硝酸、氯气和氯化亚硝酰等一系列强氧化剂,同时还有高浓度的氯离子,王水的氧化能力比硝酸强,一些不溶于硝酸的金属如金、铂等能被王水溶解,王水因此被称为“水”中之王。王水溶解金和铂的反应方程式如下: Au+HNO3+4HCl=H[AuCl4]+NO+2H2O
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O
最常见和为人熟知的王水为硝酸和盐酸的混合液,但是其中的氧化剂HNO3可以用其他氧化性强酸所代替。
王水的配合是很巧妙的,3个条件:
一:
两种强酸。
二:
其中一种是配合性强的酸,保证大量的Cl-(Cl-一定的络合性),F-虽然表现为更强的金属配合性,但是HF在水中难以完全电离,难以保证大量F-的存在;Br-太容易被氧化,难以保证整个溶液强有力的氧化性。所以必须用盐酸。
三:
另一种酸氧化性必须适中,要足够强,但是不能太强,太强,把Cl-(氯离子)大量氧化了就丧失了第二个条件,而浓硝酸刚好是常见酸中满足这个条件的。
这两种最常见的酸配伍可以说是天作之合。但是其实硝酸其实可以用别的酸代替,比如硒酸(H2SeO4),但是并不常见,但是却和王水有一样的效用,好处是还原产物(H2SeO3或者SeO2)不是气体,不会造成气体中毒,反应产物全部在溶液中。
四、王水及其氧化作用
王水是由1体积的浓硝酸和3体积的浓盐酸混合而成的(严格地说是在制取混酸所用的溶质HNO3和HCl的物质的量之比为1∶3)。王水的氧化能力极强,曾被认为是酸中之王(直到超强酸的发现,才知道王水是小巫见大巫)。一些不溶于硝酸的金属,如金、铂等都可以被王水溶解(铂必须被加热才能缓慢反应)。
(铂金反应很慢基本肉眼难以观察到)
高浓度的氯离子与其金属离子可形成稳定的络离子,如[AuCl4]-:
(理论上的化学式)
从而使金的标准电极电位减小,有利于反应向金属溶解的方向进行。总反应的化学方程式可表示为:
(其中铂金反应尚待研究)
由于金和铂能溶解于王水中,人们的金铂首饰(黄金)在被首饰加工商加工清洗时,常会在不知不觉中被加工商用这种方法偷取,损害消费者的利益。
王水能够溶解金和铂的原因,过去曾被认为是在王水中产生了原子氯和强氧化性的氯化亚硝基的缘故:
HNO3+3HCl=NOCl+Cl2+2H2O
现在看来,主要是由于大量氯离子的存在,能够形成配位离子,从而改变了电极电势的结果。以金为例:
Au与Cl配位形成AuCl4
+ 3e = Au; E = 1.52V AuCl4 + 3e = Au + 4Cl; E = 1.002V 可以看出,在没有氯离子存在下,硝酸和氯都不易氧化金,但是当金在氯离子存在下时,它的电极电势降低很多,换句话讲,由于形成AuCl4而增强了金的还原能力。这时氯甚至浓硝酸也能氧化Au成AuCl4。所以,王水能溶解金的主要原因不是王水的氧化能力被增强,而是金属的还原能力被增强。
五、中科院院士、空间物理学家
王水院士,1942年4月出生,1961年毕业于南京大学,分配到中国科学技术大学任教至今。
1978年评为副教授,1985年晋升教授。
1986年被批准为博士生导师。
1993年当选为中国科学院院士。现任中国地球物理学会理事长,中国空间科学学会常务理事,国际科联(ICSU)日地物理科学委员会(SCOSTEP)学科代表。
主要从事空间物理领域研究。
20世纪70年代,与合作者率先在我国开展哨声和甚低频发射的观测和研究,提出了低纬导管哨声的观测证据。
80年代与合作者发展了球坐标中的Euler全隐式计算格式和多维时变流动的近特征边界条件,对日冕扰动传播等太阳大气动力学现象开展了系统的磁流体力学数值研究。
80年代末,与合作者研究了具有超Alfven速流动电流片的稳定性,讨论了其物理性质及其非线性演化。
90年代与合作者研究了日冕电流片中的磁场重联过程,并出版了专著《磁场重联》
。
21世纪与合作者开展了空间等离子体物理的理论研究,通过全粒子数值模拟发现无碰撞磁场重联可以激发哨声波。
已发表论文160余篇,培养了20多名博士生和硕士生,曾获得1993年国家自然科学二等奖、多项中国科学院自然科学奖及2000年何梁何利科学技术进步奖。