聚合酶链反应
聚合酶链反应或多聚酶链反应(Polymerase Chain Reaction,PCR),又称无细胞克隆技术(“free bacteria”cloning technique),是一种对特定的DNA片段在体外进行快速扩增的新方法。1985年国PE-Cetus公司人类遗传研究室的Mullis 等发明了具有划时代意义的聚合酶链反应。该方法一改传统分子克隆技术的模式,不通过活细胞,操作简便,在数小时内可使几个拷贝的模板序列甚至一个DNA分子扩增10^7~10^8倍,大大提高了DNA的得率。已广泛应用到分子生物学研究的各个领域。
概述
PCR技术是80年代中期发展起来的体外核酸扩增技术。 它具有特异、敏感、产率高、 快速、 简便、重复性好、易自动化等突出优点。
PCR技术最早由美国Cetus公司人类遗传研究室Kary Mullis及同事于1985年发现并研制成功的;最早的应用报道是Saiki等1985年将PCR技术应用于β-珠蛋白基因扩增和镰刀状红细胞贫血的产前诊断。随后使用了1976年Chien等分离的热稳定性Taq DNA聚合酶,使PCR操作大为简化,并使PCR自动化成为可能;1987年Kary Mullis等完成了自动化操作装置,使PCR技术进行实用阶段。
复旦大学1988年起开始研制耐热性多聚酶,军事医学科学院马立人教授等在1989年研制成功了PCR自动装置,并且不断推陈出新,最近研制的PTC-51A/B型DNA热循环仪体积小,造型美观,价格适宜,操作简单,尤为适宜国内应用。
PCR发明不到10年,却已获得广泛应用。每年都有上千篇文章 发表。1991年,期刊“PCR方法与应用”(PCr Methods and Application)在美国创刊,使有关学者有了自己的论坛和参考的专业期刊。PCR技术作为一种方法学革命,必将大大推动分子生物学各有关学科的研究,使其达到一个新的高度。
1993年度诺贝尔化学将已于10月13日揭晓,Kary Mullis因发明了“聚合酶链式反应”而获得此殊荣。现在世界各地都在使用PCR检测病人血液中的微量遗传物质,这一成就为精确诊断艾滋病及其它病症铺平了道路。瑞典皇家科学院说:“PCR方法已经广泛应用于生物医学中。该方法同DNA测序法结合起来很可能将成为研究动植物分类学的一种革新工具。”一名加拿大籍英国科学家Michael Smith因开创了“寡核苷酸基因定点诱变”的方法而与Mullis同享此荣。
原理
PCR是体外酶促合成特异DNA片段的新方法,主要由高温变性、 低温退火和适温延伸三个步骤反复的热循环构成:即在高温(95℃)下,待扩增的靶DNA双链受热变性成为两条单链DNA模板;而后在低温(37~55℃)情况下,两条人工合成的寡核苷酸引物与互补的单链DNA模板结合,形成部分双链;在Taq酶的最适温度(72℃)下,以引物3’端为合成的起点,以单核苷酸为原料,沿模板以5’→3’方向延伸,合成DNA新链。这样,每一双链的DNA模板,经过一次解链、退火、延伸三个步骤的热循环后就成了两条双链DNA分子。如此反复进行,每一次循环所产生的DNA均能成为下一次循环的模板,每一次循环都使两条人工合成的引物间的DNA特异区拷贝数扩增一倍,PCR产物得以2n的批数形式迅速扩增,经过25~30个循环后,理论上可使基因扩增109倍以上,实际上一般可达106~107倍。
DNA是由四种碱基按互补配对原则(即腺嘌呤A对胸腺嘧啶T,鸟嘌呤G对胞嘧啶C)组成的螺旋双链。在细胞内,DNA复制时,解螺旋酶首先解开双链让它变成单链做为模板,然后,另一种酶--RNA聚合酶合成一小段引物(primer)结合到DNA模板上,最后,DNA合成酶以这段引物为起点,合成与DNA模板配对的新链。PCR即是在体外模拟DNA复制的过程,它用加热的办法让所研究的DNA片段变性变成两条单链,人工合成两个引物让它们结合到DNA模板的两端,DNA聚合酶即可以大量复制该模板。
假设扩增效率为“X”,循环数为“n”,则二者与扩增倍数“y”的关系式可表示为:y=(1 X)n。扩增30个循环即n=30时,若X=100%,则y=230=1073741824(>109);而若X=80%时,则y=1.830=45517159.6(>107)。由此可见,其扩增的倍数是巨大的,将扩增产物进行电泳,经溴化乙锭染色,在紫外灶照射下(254nm)一般都可见到DNA的特异扩增区带。
反应体系
一、PCR操作范例
PCR基本原理示意图(如右图):
在一个典型的PCR反应体系中需加入:适宜的缓冲液、微量的模板DNA、4×dNTPs、耐热性多聚酶、Mg2 和两个合成的DNA引物。模板DNa 94℃变性1min,引物与模板40~60℃退火1min,72℃延伸2min。在首次循环前模板预变性3~5min;在末次循环后,样品仍需继续延伸3~5min以上,确保扩增的DNA为双链DNA。为便于了解PCR反应中各成份的组成,加入量和反应条件,使人们以此为基础,对不同的研究对象逐项改变来找到最佳反应条件,特列举Perkin Elmer Cetus公司Gene Amp DNA试剂盒提供的典型反应条件供参考。
二、PCR反应系统的组成
(一)PCR缓冲液(PCrBuffer)
用于PCR的标准缓冲液见PCR操作范例。于72℃时,反应体系的pH值将下降1个单位,接近于7.2。二价阳离子的存在至关重要,影响PCR的特异性和产量。实验表明,Mg2 优于Mn2 ,而Ca2 无任何作用。
1.Mg2 浓度Mg2 的最佳浓度为1.5mmol/L(当各种dNTP浓度为200mmol/L时),但并非对任何一种模板与引物的结合都是最佳的。首次使用靶序列和引物结合时,都要把Mg2 浓度调到最佳,其浓度变化范围为1~10mmol/L。Mg2 过量易生成非特异性扩增产物,Mg2 不足易使产量降低。
样品中存在的较高浓度的螯合剂如EDTA或高浓度带负电荷的离子基团如磷酸根,会与Mg2 结合而降低Mg2 有效浓度。因此,用作模板的DNA应溶于10mmol/l Tris-HCl(pH7.6)0.1mmol/L EDTA中。
dNTP含有磷酸根,其浓度变化将影响Mg2 的有效浓度。标准反应体系中4×dTNPs的总浓度为0.8mmol/L,低于1.5mmol/L的Mg2 浓度。因此,在高浓度DNA及dNTP条件时,必须相应调整Mg2 的浓度。
2.Tris -HCl缓冲液在PCR中使用10~50mmol/L的Tris –HCl缓冲液,很少使用其他类型的缓冲液。Tris缓冲液是一种双极化的离子缓冲液,pKa为8.3(20℃),△pKa为0.021/℃。因此,20mmol/l Tris pH8.3(20℃)时,在典型的热循环条件下,真正的pH值在7.8~6.8之间。
3.KCl浓度K 浓度在50mmol/L 时能促进引物退火。但研究表明,NaCl浓度在50mmol/L时,KCl浓度高于50mmol/L将会抑制Taq酶的活性,少加或不加KCl对PCR结果没有太大影响。
4.明胶明胶和BSA或非离子型去垢剂具有稳定酶的作用。一般用量为100μg/ml,但现在的研究表明,加或不加都能得到良好和PCR结果,影响不大。
5.二甲基亚砜(DMSO)在使用Klenow片段进行PCR时DMSO是有用的;加入10%DM-SO有利于减少DNA的二级结构,使(G C)%含量高的模板易于完全变性,在反应体系中加入DMSO使PCR产物直接测序更易进行,但超过10%时会抑制Taq DNA聚合酶的活性,因此,大多数并不使用DMSO。
(二)四种脱氧三磷酸核苷酸(4×dNTPs)
在PCR反体系中dNTP终浓度高于50mmol/L会抑制Taq酶的活性,使用低浓度dNTP可以减少在非靶位置启动和延伸时核苷酸错误掺入,高浓度dNTPs易产生错误掺入,而浓度太低,势必降低反应物的产量。PCR常用的浓度为50~200μmol/L,不能低于10~15μmol/L。四种dNTP的浓度应相同,其中任何一种浓度偏高或偏低,都会诱导聚合酶的错误掺入,降低合成速度,过早终止反应。
决定最低dNTP浓度的因素是靶序列DNA的长度和组成,例如,在100μl反应体系中,4×dNTPs浓度若用20μmol/L,基本满足合成2.6μg DNA或10pmol的400bp序列。50μmol/L的4×dNTPs可以合成6.6μgDNA,而200μmol/L足以合成25μg/DNA。
购自厂商的dNTP溶液一般均未调pH,应用1mol/l NaOH将dNTP贮存液pH调至7.0,以保证反应的pH值不低于7.1。市购的游离核苷酸冻干粉,溶解后要用NaOH中和,再用紫外分光光度计定量。
(三)引物的量
引物在PCR反应中的浓度一般在0.1~1μmol/L之间。浓度过高易形成引物二聚体且产生非特异性产物。一般来说用低浓度引物经济、特异,但浓度过低,不足以完成30个循环的扩增反应,则会降低PCR的产率。
(四)TaqDNA聚合酶的量
典型PCR反应混合物中,所用酶浓度为2.5U/μl,常用范围为1~4U/100μl。由于DNA模板的不同和引物不同,以及其它条件的差异,多聚酶的用量亦有差异,酶量过多会导致非特异产物的增加。
由于生产厂家所用兵配方、制造条件以及活性定义不同,不同厂商供应的TaqDNA聚合酶性能也有所不同。
Cetus公司酶定义是:1个酶单位是指在以下分析条件下,于74℃,30min内使10nmmol的dNTP掺入酸不溶性成分所需的酶。测定时间为10min,折算成30min掺入量。
分析条件为25nmol/L TAPS(三羟基-甲基-氨基丙烷磺酸钠pH9.3.25℃),50mmol/l KCl,2mmol/L MgCl2.1mmol/L β-ME(巯基乙醇),dATP、dTTP、dGTP各200mmol/L,dCTP为100mmol/L(由不标记及α-32P标记混合),12.μg变性鲱鱼精子DNA,最终体积50μl。
(五)模板
单、双链DNA或RNA都可以作为PCR的样品。若起始材料是RNA,须先通过逆转录得到第一条cDNA。虽然PCR可以仅用极微量的样品,甚至是来自单一细胞的DNA,但为了保证反应的特异性,还应用ng级的克隆DNA,μg水平的单拷贝染色体DNA或104拷贝的待扩增片段作为起始材料,模板可以是粗品,但不能混有任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂以及能结合DNA的蛋白。
DNA的大小并不是关键的因素,但当使用极高分子量的DNA(如基因组的DNA时),如用超声处理或用切点罕见的限制酶(如Sal1和Not1)先行消化,则扩增效果更好。闭环靶序列DNA的扩增效率略低于线状DNA,因此,用质粒作反应模板时最好先将其线状化。
模板靶序列的浓度因情况而异,往往非实验人员所控制,实验可按已知靶序列量逆减的方式(1ng,0.1ng,0.001ng等),设置一组对照反应,以检测扩增反应的灵敏度是否符合要求。
(六)石蜡油
PCR扩增时建议在混合物上面铺一层石蜡油,减少PCR过程中尤其是变性时液体蒸发所造成的产物的丢失。研究表明,应用石蜡油可使扩增产量增加5倍,可能与石蜡油维持热恒定和整个反应体系中盐浓度有关。
三、电泳分析
在实际工作中常采用琼脂糖凝胶电泳。一般情况下先在电泳缓冲液或凝胶中加1%溴化乙锭(EB)(每100ml加100μl),然后将已经制备好的1%~2%琼脂糖凝胶(用电泳缓冲液配制)放入电泳槽内,加入待测样品10μl,同时用分子量标准品作标记。琼脂糖浓度应按分离DNA片段的大小进行选择,一般用1.5%~2%,电泳电压75V,待样品进行凝胶内距胶末端1cm时,切断电源,取出凝胶在紫外灯下直接观察结果。
由于溴化乙锭可与双链DNA形成结合物,在紫外灯下能发射荧光,使EB的荧光强度增强80~100倍,所以,电泳后凝胶在紫外灯下可直接观察。一般肉眼观察DNA量可达10ng,其荧光强度与DNA含量成正比。
DNA分子在凝胶中泳动速度决定于电荷效应及分子效应。前者由所带净电荷量决定,而后者与分子大小及构型有关。按照DNA分子大小,其凝胶浓度可做不同的调整。有条件的实验室也可用聚丙烯酰胺凝胶电泳(PAGE)分析扩增的DNA片段。
四、影响PCR的主要因素
PCR技术必须有人工合成的合理引物和提取的样品DNA,然后才进行自动热循环,最后进行产物鉴定与分析。引物设计与合成目前只能在少数技术力量较强的研究院、所进行,临床应用只需购买PCR检测试剂盒就可开展工作,PCR自动热循环中影响因素很多,对不同的DNA样品,PCR反应中各种成份加入量和温度循环参数均不一致。现将几种主要影响因素介绍如下。
一、温度循环参数
在PCR自动热循环中,最关键的因素是变性与退火的温度。如操作范例所示,其变性、退火、延伸的条件是:94℃60s, 37℃60s, 72℃120s,共25~30个循环,扩增片段500bp。在这里,每一步的时间应从反应混合液达到所要求的温度后开始计算。在自动热循环仪内由混合液原温度变至所要求温度的时间需要30~60s,这一迟滞时间的长短取决于几个因素,包括反应管类型、壁厚、反应混合液体积、热源(水浴或加热块)以及两步骤间的温度差,在设置热循环时应充分给以重视和考虑,对每一仪器均应进行实测。
关于热循环时间的另一个重要考虑是两条引物之间的距离;距离越远,合成靶序列全长所需的时间也越长,前文给出的反应时间是按最适于合成长度500bp的靶序列拟定的。下面就各种温度的选择作一介绍。
1.模板变性温度变性温度是决定PCR反应中双链DNA解链的温度,达不到变性温度就不会产生单链DNA模板,PCR也就不会启动。变性温度低则变性不完全,DNA双链会很快复性,因而减少产量。一般取90~95℃。样品一旦到达此温度宜迅速冷却到退火温度。DNA变性只需要几秒种,时间过久没有必要;反之,在高温时间应尽量缩短,以保持Taq DNA聚合酶的活力,加入Taq DNA聚合酶后最高变性温度不宜超过95℃。
2.引物退火温度退火温度决定PCR特异性与产量;温度高特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低产量高,但过低可造成引物与模板错配,非特异性产物增加。一般先由37℃反应条件开始,设置一系列对照反应,以确定某一特定反应的最适退火温度。也可根据引物的(G C)%含量进行推测,把握试验的起始点,一般试验中退火温度比扩增引物的融解温度TTm低5℃,可按公式进行计算:
Ta = Tm -5℃= 4(G C) 2(A T)-5℃
其中A,T,G,C分别表示相应碱基的个数。例如,20个碱基的引物,如果(G C)%含量为50%时,则Ta的起点可设在55℃。在典型的引物浓度时(如0.2μmol/L),退火反应数秒即可完成,长时间退火没有必要。
3.引物延伸温度温度的选择取决于Taq DNA聚合酶的最适温度。一般取70~75℃,在72℃时酶催化核苷酸的标准速率可达35~100个核苷酸/秒。每分钟可延伸1kb的长度,其速度取决于缓冲溶液的组成、pH值、盐浓度与DNA模板的性质。扩增片段如短于150bp,则可省略延伸这一步,而成为双温循环,因Taq DNA聚合酶在退火温度下足以完成短序列的合成。对于100~300bp之间的短序列片段,采用快速、简便的双温循环是行之有效的。此时,引物延伸温度与退火温度相同。对于1kb以上的DNA片段,可根据片段长度将延伸时间控制在1~7min,与此同时,在PCR缓冲液中需加入明胶或BSA试剂,使Taq DNA聚合酶在长时间内保持良好的活性与稳定性;15%~20%的甘油有助于扩增2.5kb左右或较长DNA片段。
4.循环次数常规PCR一般为25~40个周期。一般的错误是循环次数过多,非特异性背景严重,复杂度增加。当然循环反应的次数太少,则产率偏低。所以,在保证产物得率前提下,应尽量减少循环次数。
扩增结束后,样品冷却并置4℃保存。
二、引物引物设计
要扩增模板DNA,首先要设计两条寡核苷酸引物,所谓引物,实际上就是两段与待扩增靶DNA序列互补的寡核苷酸片段,两引物间距离决定扩增片段的长度,两引物的5’端决定扩增产物的两个5’末端位置。由此可见,引物是决定PCR扩增片段长度、位置和结果的关键,引物设计也就更为重要。
引物设计的必要条件是与引物互补的靶DNA序列必须是已知的,两引物之间的序列未必清楚,这两段已知序列一般为15~20个碱基,可以用DNA合成仪合成与其对应互补的二条引物,除此之外,引物设计一般遵循的原则包括:
1.引物长度根据统计学计算,长约17个碱基的寡核苷酸序列在人的基因组中可能出现的机率的为1次。因此,引物长度一般最低不少于16个核苷酸,而最高不超过30个核苷酸,最佳长度为20~24个核苷酸。这样短的寡核苷酸在聚合反应温度(通过72℃)下不会形成稳定的杂合体。有时可在5’端添加不与模板互补的序列,如限制性酶切位点或启动因子等,以完成基因克隆和其他特殊需要;引物5’端生物素标记或荧光标记可用于微生物检测等各种目的。有时引物不起作用,理由不明,可移动位置来解决。
2.(G C)%含量引物的组成应均匀,尽量避免含有相同的碱基多聚体。两个引物中(G C)%含量应尽量相似,在已知扩增片段(G C)%含量时宜接近于待扩增片段,一般以40%~60%为佳。
3.引物内部应避免内部形成明显的次级结构,尤其是发夹结构(hairpinstructures)。例如:
4.引物之间两个引物之间不应发生互补,特别是在引物3’端,即使无法避免,其3’端互补碱基也不应大于2个碱基,否则易生成“引物二聚体”或“引物二倍体”(Primer dimer)。所谓引物二聚体实质上是在DNA聚合酶作用下,一条引物在另一条引物序列上进行延伸所形成的与二条引物长度相近的双链DNA片段,是PCR常见的副产品,有时甚至成为主要产物。
另外,两条引物之间避免有同源序列,尤为连续6个以上相同碱基的寡核苷酸片段,否则两条引物会相互竞争模板的同一位点;同样,引物与待扩增靶DNA或样品DNA的其它序列也不能存在6个以上碱基的同源序列。否则,引物就会与其它位点结合,使特异扩增减少,非特异扩增增加。
5.引物3’端配对DNA聚合酶是在引物3’端添加单核苷酸,所以,引物3’端5~6个碱基与靶DNA的配对要求必须精确和严格,这样才能保证PCR有效扩增。
引物设计是否合理可用PCRDESN软件和美国PRIMER软件进行计算机检索来核定。
人工合成的寡核苷酸引于最好经过色谱(层析)纯化或PAGE纯化,以除去未能合成至全长的短链等杂质。纯化引物在25%乙腈溶液中4℃保存可阻止微生物的生长;一般情况下,不用的引物应保存在-20℃冰箱中,在液体中引物能保存6个月,冻干后可保存1~2年。
三、DNA聚合酶
在1956年Kornberg等就从大肠杆菌提取液中发现了DNA聚合酶,并且得到了DNA聚合酶Ⅰ纯品。DNA聚合酶Ⅰ是由分子量为109000的一条多肽链构成,此酶可被枯草杆菌蛋白酶分解为两个片段,一个片段分子量为76000,有聚合酶活性,并有3’→5外切酶活力,即Klenow片段(Klenow fragment)。另一个片段分子量为34000,具有5’→’3’外切酶活力。因此,DNA聚合酶具有几种功能:一是聚合作用,以DNA为模板,将dNTP中的脱氧单核苷酸逐个加到3-OH末端。二是有’3’→5’外切酶活力,能识别和消除错配的引物末端,与复制过程中校正功能有关。三是5’→3’外切酶活力,它能从5’端水解核苷酸,还能经过几个核苷酸起作用,切除错配的核苷酸。1985年Mullis 等发明了PCR方法,以Klenow片段完成β-珠蛋白的PCR后,世界上许多实验室就考虑用耐热DNA聚合酶代替Klenow片段进行PCR,使耐热多聚酶的研究得以迅速发展。人们从生活于60℃(B.Stearothermophilus)到87℃(S.Solfatavicus)的许多菌中分离纯化出耐热DNA聚合酶,但有些酶不能耐受DNA变性所需温度,所以无法应用于PCR。
1.Taq DNA聚合酶用Taq DNA聚合酶代替大肠杆菌DNA聚合酶Ⅰ的Klenow片段是使PCR普及应用的关键。Klenow片段不能耐受95℃的双链DNA变性温度,所以每次循环都要加入新酶;而Taq DNA聚合酶可以耐受93~95℃的高温,避免了不断补加多聚酶的繁琐操作,同时使退火和延伸温度得以提高,减少了非特异性产物和DNA二级结构对PCR的干扰,增进了PCR特异性、产量和敏感度,二者相比,其主要区别在于:①Klenow酶的最适温度为37℃,扩增的产物并非全是目的序列,需用探针检测。Taq酶则不仅产率高而特异性也高。它的最适温度为74~75℃。因而使退火温度可以提高,使退火严格性提高,减少错配引物的延伸。②循环后期酶量渐感不足而产生平坡。到达平玻的循环次数,Klenow酶为20个(均用1μg基因组DNA开始)而Taq酶为30个。③延伸片段长度Taq酶为10kb以内,而Klenow酶为400bp以内。
Taq酶由水栖高温菌(Thermusaquatics)YT1蓖株中分离而得。此菌于1969年由Brock分离自美国黄石公园温泉,作为栖热杆菌的标准菌株,其生长温度为70~75℃。最初从中分离到分子量60~68KDa,比活性为2000~8000U/mg的DNA聚合酶。后来Cetus公司的Kary Mullis等又分离到比活为20万U/mg的纯酶,分子量为93910。此种9.4KDa酶的最适温度为75~80℃,与单纯核苷酸的结合率(Kcat)可达150核苷酸(nt)/s酶分子。以M13模板,用富含G C的30bp引物延伸,70℃时Kact>60nt/s;55℃可达24nt/s;37℃时为1.5nt/s,而22℃时低至0.25nt/s。高于90℃时DNA合成活性甚差,这种高温条件下,引物与模板已不能牢固结合。
在PCR反应混合液中,Taq酶于92.5℃,95℃及97.5℃保持其50%活力的时间分别为130、40及5~6min,在50次循环的PCR中当管内最高温度为95℃。每循环为20s时尚可保持65%活力。Taq 酶在95℃的半寿期为40min,故在PCR循环中选用的变性温度,不宜高于95℃。
Taq酶现已可用基因重组的方法生产,商品名为Ampli Taq(Cetus公司)。Taq酶的完整基因长2499bp,在大肠杆菌中表达生产,含832个氨基酸。在氨基酸序列上与大肠杆菌DNA聚合酶Ⅰ有38%是一致的,包括对dNTP结合,引物与模板作用区均存在于Taq酶中。
Taq酶具有依赖DNA合成的5’→’3’外切酶活性,因此,模板上有一段退火的3’-磷酸化的“阻断物”,会被逐个切除而不会阻止来自上游引物链的延伸,而对于5’-32P标记的合成寡核苷酸引物,则无论是单链或是与模板复性,都未发现降解,所以该种活性不会影响PCR结果。Taq酶没有3’→’5’外切酶活性,如果发生dNTP错误掺入,这种酶没有校正能力,因此运用Taq酶进行PCR,产物中点突变较多,对克隆等不太有利。一般错掺率为1.25×10-4~1×10-5(4×dNTPs浓度分别为200μmol/L,Mg2 为1.5mmol/L,在55℃退火)。但不含3’→5’外切酶活性对测序有利。
2.影响酶活力的因素Taq酶的活力受Mg2 离子的影响。用鲱精DNA为模板,总dNTP浓度0.7~0.8mmol/L,Mg2 为2.0mmol/L时激活能力最高。浓度超过此值产生抑制。10mmol/l MgCl2抑制活力达40%~50%。dNTP能与Mg2 结合,故游离Mg2 只是结合后剩余的量。若总dNTP浓度高至4~6mmol/L时,Taq酶活力要降低20~30%,即底物抑制。
dNTP浓度低时PCR产率及特异性均增高,适合于用扩增掺入法标记生物素及放射性元素。当100μl PCR液中含dNTP各40μmol/L时就足以合成2.6μg的DNA(dNTP消耗一半)。
用鲱精DNA,70℃,10min内dNTP的掺入量计算,标准条件为100%。
纯9.4KDa Taq酶不含3’→5’核酸外切酶活力。误掺入率取决于dNTP浓度。但Taq酶具有DNA依赖的链移位5’→3’核酸外切酶活力。对5’→3’32P标记寡核苷酸单链,或与MB模板杂交时均只有极少的降解力。
中等浓度KCl能刺激Taq酶合成活力达50%~60%,最佳KCl浓度为50mmol/L,浓度更高有抑制作用,>200mmol/L的KCl可使酶失活。
加入50mmol/L NH4Cl或NH4Ac或NaCl,可产生中度抑制或无作用。
低浓度尿素、DMSO、DMF或甲酰胺影响不大,吐温20/NP40可消除SDS(0.01%及0.1%)的抑制作用。
3.第二代耐热DNA聚合酶Stoffel片段:Cetus公司的Stoffel将TaqDNA聚合酶的5’→3’外切酶活性片段(N端289个氨基酸)去除,称为stoffel片段。其97.5℃的半衰期从Taq DNA聚合酶的5~6min提高到20min,同时该酶片段也对两个或更多模板位点的扩增反应即复合PCR(Multiplex PCR)更为有利。
VentTMDNA多聚酶:是美国New England Biolabs公司从潜水艇排气孔(Vent)中分离的超级嗜热菌-能生长于98℃中的Thermococcus litoralis中分离纯化得到的,故名Vent酶。它的一些酶学性质较Taq DNA聚合酶更为优越,它能耐100℃高温且2h以上仍有活力,并且具有3’→5’外切酶活性的校正能力,错误扩增的机率比Taq酶降低一倍。后来该公司又从深水潜艇(2010m)排气孔分离的能在104℃生长的Pyococcus菌GB-D株植入Deep Vent DNA聚合酶基因而表达的Deep Vent DNA聚合酶,在95℃的半寿期达23h(Vent酶为6.7h,Taq酶为1h)。
4.RTth逆转录酶(rTth Reverse Transcriptase)目前逆转录-PCR(RT-PCR)的发展很快,所以对耐热的依赖于RNA的DNA多聚酶的研究也有进展。有实验表明Taq DNA多聚酶有依赖于RNA的DNA聚合酶活性,但活性较弱。Cetus公司于1991年推出一种rTth Reverse Tran-scriptase,有很好的依赖于RNA的耐热DNA聚合酶活性和依赖于DNA的耐热DNA聚合酶活性,二种活性分别依赖于Mn2 Mg2 ,这样就可分别控制酶活性。利用该酶只需250ng的总RNA即可有效地进行RT-PCR,得到特异的DNA片段,从而非常有利于逆转录PCR的发展。
耐热DNA聚合酶的研究得到长足的发展,这在PCR发展中起到了重要的作用。相信随着进一步的研究,将使人们对耐热DNA聚合酶的认识和应用更进一步地发展。
我国的PCR研究发展很快,其关键试剂-耐热DNA聚合酶-也已有几个实验室能够分离纯化,如复旦大学遗传学研究所、华美公司、中国医学科学院基础医学研究所。后二者的菌株为Thermus aquaticus YT-1。前者则是从自己筛选的嗜热菌中分离纯化,复旦大学遗传所亦已成功地克隆了该聚合酶的基因并获得了耐热F4DNA聚合酶,其酶学性质非常接近于Taq DNA聚合酶,为中国PCR的开展提供了保证。
四、影响PCR特异性的因素
通过上述内容。可以看出有许多因素可以影响PCR的特异性,在此我们作一归纳,供大家参考:①退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。②减短退火时间及延伸时间可以减少错误引发及错误延伸。③引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化。④改变MgCl2(有时KCl)浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。⑤模板中如果存在次级结构,例如待扩增的片段易自行形成发夹结构时,可在PCR混合物中的4×dNTPs中加入7-脱氮-2’-脱氧鸟苷-5’-三磷酸(7-deaza-2’-deoxyguanosine-5’-trihosphate)(de7GTP)。用de7GTP与dGTP比例为3:1的混合物(150μmol/l de7GTP 50μmol/L dGTP)代替200μmol/l dGTP,则可阻非特异性产物的生成。
五、扩增平坡
扩增反应并不是可以无穷地进行下去的,经过一定的循环周期后需扩增的片段不再按指数增多而逐渐进入平坡;进入平坡的循环次数,取决于起始时存在的模板拷贝数以及合成的DNA总量。所谓平坡就是批PCR循环的后期,合成产物达0.3~1pmol时,由于产物的堆积,使原来以指数增加的速率变成平坦的曲线。造成PCR进入平坡的原因有:引物和dNTP等消耗完毕、Taq酶失活,这几中因素在标准反应中均不会出现。此外,还有几种可能:
1.底物过剩因DNA合成量多于反应液中存在的Taq酶,在100μl反应液中含2.5Utaq酶而DNA合成量达1μg(3nmol脱氧核苷酸)时,开始变为底物过剩。延长延伸时间或添加Taq酶,可以克服之。但不实用,因每进行下一循环就要延长延伸时间一倍及多加一倍Taq酶,才能继续保持指数增长。
2.非特异性扩增产物的竞争与上述情况密切相关,此时不需要的DNA片段与需要的片段同时竞争聚合酶,要克服这一情况是要提高反应特异性,使不需要片段不能大量积聚。
3.退火时产物的单链自己缔合两条单链的DNA片段在退火时除了与引物缔合外,也可以自行缔合,这也会阻止产品增多。当产物浓度到达10pmol/100μl时即可发生此现象,除稀释外无法克服。
4.变性在高浓度产物条件下,产物解链不完全,以及最终产物的阻化作用(焦磷酸化,双链DNA)。
总而言之,PCR的条件是随系统的而异的,并无统一的最佳条件,先选用通用的条件扩增,然后稍稍改变各参数,可以达到优化,以取得优良的特异性和产率。
应用模式
一、兼并引物(DegeneratePrimer)PCR
密码子具有兼并性,单以氨基酸顺序推测编码的DNA序列是不精确的,但可以设计成对兼并引物,扩增所有编码已知顺序的核酸序列。用兼并引物时寡核苷酸中核苷酸序列可以改变,但核苷酸的数量应相同。兼并度越低,产物特异性越强,设计引物时应尽量选择兼并性小的氨基酸,并避免引物3’末端兼并,针对兼并的混合引物已成功地用于未知靶DNA的扩增、克隆和序列分析。现已成功地克隆了猪尿酸氧化酶基因、糖尿病相关肽基因和哺乳动物与禽类的嗜肝病毒基因。用脱氧肌苷(deoxyinosine;DI)引物进行PCR,可以代替编码蛋白的多种兼并密码子中的兼并碱基,DI的特异性主要受cDNA浓度影响。
二、套式引物(NestedPrimer)PCR
用第一套引物扩增15~30个循环,再用扩增DNA片段内设定的第二套引物扩增15~30个循环,这样可使待扩增序列得到高效扩增,而次级结构却很少扩增。用起始引物限量方法或Centricon30(Amicon)分子滤过器离心,在第二套引物加入前去除第一引物。此方法已成功地用来分析中国仓鼠卵巢细胞AS52的分子突变。AS52细胞含有单拷贝的细胞gpt(guanine phos-phribosytransferase)基因,与哺乳动物具有同源性。套式引物PCR减少了引物非特异性退火,从而增加了特异性扩增,提高了扩增效率。对环境样品中微生物检测和单拷贝的基因靶DNA的扩增是非常有效的。
若将套式PCR的内外引物稍加改变,延长外引物长度(至25~30bp),同进缩短内引物长度(15~17bp),使外引物先在高温退火温度下做双温循环扩增,然后改换至三温循环,使内引物在外引物扩增的基础上作低温火温度的三温循环直到扩增完成,这样就可以使两套引物一次同时加入,两种循环一气呵成,等于只做一次PCR,而灵敏度与套式二次PCR无异,在我们最近推出的PTc 51气流式DNA热循环仪上就可以完成全部程序。套式一次PCR的成功,使PCR检测的全过程可以在5h内完成,使当天出检验报告成为现实,也使PCR检测走入临床有了现实的基础。
三、复合PCR(Multiplex PCR)
用多对引物同时扩增几条DNA片段的方法称为复合PCR。这一方法最初是由Chanberlain 等检测人的基因发展而来。Bej等随之发展了对环境样品中不同属细菌相关基因序列同时PCR扩增的检测方法。两种不同的军团菌(legionella)基因,一为特异嗜肺L基因(mip),另一种为L-5SrRNA基因,通过引物摇摆(staggered)添加进行复合PCR。首先mip引物PCR扩增7个循环,然后加入5SrRNA引物PCR扩增38个循环。加入不同量的LacZ和LacB基因引物进行PCR扩增可以检测大肠杆菌和与人类粪便污染有关的细菌包括E.coli大肠菌、肠源致病沙门氏菌和志贺氏菌。
在复合PCR中,所有引物Ta值应相近。如果两对引物Tq值差异超过±℃10%,会使扩增产物的量明显不同,其中一种扩增产物或目的DNA很难观察到。另外,靶DNA的长度也应相近,差别大时短片的靶DNA会优先扩增,因此,会产生不同产量的扩增产物,为此,须采用DNA摇摆扩增或加入不等量的引物方法进行解决。
四、反向PCR(Inverse PCR或Reverse PCR)
反向PCR的目的在于扩增一段已知序列旁侧的DNA,也就是说这一反应体系不是在一对引物之间而是在引物外侧合成DNA。反向PCR可用于研究与已知DNA区段相连接的未知染色体序列,因此又可称为染色体缓移或染色体步移。这时选择的引物虽然与核心DNA区两末端序列互补,但两引物3’端是相互反向的。扩增前先用限制性内切酶酶切样品DNA,然后用DNA连接酶连接成一个环状DNA分子,通过反向PCR扩增引物的上游片段和下游片段;现已制备了酵母人工染色体(YAC)大的线状DNA片段的杂交探针,这对于转座子插入序列的确定和基因库染色体上DNA片段序列的识别十分重要。
该方法的不足是:①需要从许多酶中选择限制酶,或者说必须选择一种合适的酶进行酶切才能得到合理大小的DNA片段。这种选择不能在非酶切位点切断靶DNA。②大多数有核基因组含有大量中度和高度重复序列,而在YAC或Cosmid中的未知功能序列中有时也会有这些序列,这样,通过反向PCR得到的探针就有可能与多个基因序列杂交。
利用反向PCR可对未知序列扩增后进行分析,探索邻接已知DNA片段的序列,并可将仅知部分序列的全长cDNA进行分子克隆,建立全长的DNA探针。适用于基因游走、转位因子和已知序列DNA旁侧病毒整合位点分析等研究。
五、不对称PCR(Asymmetric PCR)
不对称PCR的基本原理是采用不等量的一对引物产生大量的单链DNA(ss-DNA)。这两种引物分别称为限制性引物与非限制性引物;其最佳比例一般为1:50~1:100,关键是限制引物的绝对量。限制性引物太多太少,均不利于制备ss-DNA。也可用普通PCR制备靶DNA双链DNA(ds-DNA),再以ds-DNA为模板,只用其中一种过量引物进行单引物PCR制备ss-DNA。产生的ds-DNA与ss-DNA由于分子量不同可以在电泳中分开,而得到纯ss-DNA。不对称PCR主要为测序制备ss-DNA,尤为用cD-NA经不对称PCR进行DNA序列分析是研究真核DNA外显子的好方法。
六、标记PCR(LP-PCR)和彩色PCR
LP-PCR(Labelled Primers PCR)是利用同位素、荧光素等对PCR引物5’端进行标记,据此检测目的基因的存在与否,与常规PCR相比更为直观,省去了限制性内切酶酶切及分子杂交等繁琐步骤,而且一次可以同时分析多种基因成分,因而特别适合于大量临床标本的基因诊断。该方法只对PCR产物进行定性鉴定。
彩色PCR(Colorcomplement assay)直译为“着色互补性检测”,是LP-PCR的一种,彩色PCR意译更为明确:它用荧光染料标记引物的5’端。荧光染料JOE和FAM呈绿色荧光;TAMRA呈红色荧光;COUM呈蓝色荧光。不同荧光标记的引物同时参加反应,扩增后的目的基因会分别带有引物5’端的染料,通过电泳或离心沉淀,肉眼就可以根据不同荧光的色泽判断目标基因是否存在及扩增基因的类型。通常仅需2种不同颜色的引物,一种作为基因检测引物;另一种作为控制条件的内对照,即可诊断基因缺失、染色体易位或感染某种病毒。检测多种点突变时,可用更多的色彩,如多点突变的遗传病、几种可疑病毒感染、HLA位点分析都可以用彩色PCR同时检测多个位点。
七、加端PCR
加端PCR(add-PCR)是使扩增产物的5’-末端加一段DNA顺序的PCR。设计加端PCR的引物时,除与模板配对的那一部分外再加上若干碱基,这样使扩增产物的末端加上额外一段DNA,如加上一个限制酶的识别顺序或特定功能的DNA片段。Stoflet等报道在结构基因前加上噬菌体T7的启动子,当然也可用于DNA片段的末端标记或引入特定的点突变。末端可加碱基的数量与引物的长短有关,当引物足够长时扩增产物或末端甚至可以加上十几个到几十个碱基。
八、锚定PCR或固定PCR
锚定PCR(AnchoredPCR,A-PCR)主要用于分析具有可变末端的DNA序列,Loh等用A-PCR对人外周血淋巴细胞T细胞受体α-链的mRNA的多变性进行了分析。先合成cDNA,并用末端脱氧核苷酸转移酶在其3’-可变区末端加上一个PolyG尾巴。Loh等恒定区与可变区连接部位设一个引物,另一个引物是一个具5’-polyG尾巴的引物。带有PolyG尾巴的引物是一个固定点,它可以并与PolyG尾巴结合,无论其余部分序列如何,只识别片段末端,利用此法可从前述mRNA中检出至少20种不同序列,每一种都是独特的,表明A-PCR不对任何特殊序列有倾向性结果,可用于T细胞、肿瘤及其它部位抗体基因的研究。
九、玻片PCR
在聚丙烯管中可以对多种含膜板材料进行PCR,而在显微玻片上用组织细胞涂片或切片直接进行DNA扩增的方法就称为玻片PCR(Slide-PCR)。
先将细胞涂片或呈单层细胞,然后用甲醇/醋酸(3:1,V/V)、Carnoy溶液、无水乙醇或4%多聚甲醛溶液固定5~15min。用蒸馏水冲洗,干燥,直接使用或保存于-20℃备用。在玻片上划20mm×28mm为免疫组化反应区。加入30μl PCR反应混合液,其中含10mmol/L TrispH8,3,50mmol/L KCl,1.5mmol/L MgCl2,200μmol/l dNTPs,100nmol/L引物,0.01%(V/V)明胶,0.2%BSA,2.5u/100μl Taq酶。然后盖上22mm×40mm的盖玻片,边缘用石蜡油封好。把玻片放入PCR热循环仪金属块上,使金属块与样品呈最大程度接触,同在聚丙烯管中一样,进行30~40个循环。对于较短的扩增片段在后期循环中变性温度可降低。反应后,将致冷玻片放在氯仿中除去大部分石蜡油,但不取出盖玻片,用一个尖镊子轻轻拈起盖玻片一角,在相对的一角中PCR反应混合液呈半月形液面,用移液器回收。一般可回收25μl混合液,将反应产物进行琼脂糖电泳或用套式PCR引物按标准PCR进行重新扩增。片上扩增物可做原位杂交显示。
在Slide-PCR中,需0.1%~1%的BSA。加入BSA可以保证扩增结果,但效率不一定很高。明胶(至少0.0001%),对扩增1kb左右的靶DNA十分重要。但对小片段扩增结果影响不大。不同的样品提取方法或固定法对Slide-PCR都可行。
Silde-PCR的机理可能是在起始变性过程中一部分DNA从细胞中洗提出来,然后在细胞和玻片的水相中进行PCR。用地高辛标记的人全基因组DNA探针杂交表明在起始循环中DNA极微量,而30个循环后很丰富。常规细胞染色表明只有少量的形态改变。
Silde-PCR对于玻片上的细胞样品提供了一种较好的方法,而不必再把这些样品从玻片上括下来,使操作简便,污染减少。本方法对于原样品量极微且需病史追踪保存的(如子宫颈涂片或涂片)具有实用价值。
十、反转录PCR方法检测RNA
RNA的多聚酶链式反应(RT-PCR)是以RNA为模板,联合逆转录反应(reverse transcrip-tion, RT)与PCR,可用于检测单个细胞或少数细胞中少于10个拷贝的特异DNA,为RNA病毒检测提供了方便;并为获得与扩增特定的RNA互补的cDNA提供了一条极为有利和有效的途径。
RNA扩增包括两个步骤:①在单引物的介导下和逆转录酶的催化下,合成RNA的互补链cDNA;②加热后cDNA与RNA链解离,然后与另一引物退火,并由DNA聚合酶催化引物延伸生成双链靶DNA,最后扩增靶DNA。
在RT-PCR中关键步骤是RNA的逆转录,cDNA的PCR与一般PCR条件一样。由于引物的高度选择性,细胞总RNA无需进行分级分离,即可直接用于RNA的PCR。但RT-PCR对RNA制品的要求极为严格,作为模板的RNA分子必须是完整的,并且不含DNA、蛋白质和其它杂质。RNA中即使含有极微量的DNA,经扩增后也会出现非特异性扩增;蛋白质未除净,与RNA结合后会影响逆转录和PCR;残存的RNase极易将膜板RNA降解掉。硫氰酸胍(GaSCN)-CsCl法或酸性硫氰酸胍-酚-氯仿法可提得理想的RNA制品,尤以后者方法为佳,适合一般实验室进行。
常用的逆转录酶有两种,即禽类成髓细胞性白血病病毒(Avianmyeloblastosis virus, AMV)和莫洛尼鼠类白血病病毒(Moloney murineleukemia virus, MO-MLV)的逆转录酶(RT)。一般情况下用Mo-MLV-RT较多,但模板RNA的二级结构严重影响逆转录时,可改用AMV-RT,因后者最适温度为72℃,高于Mo-MLV-RT的最适温度(37℃),而较高的反应温度有助于消除RNA的二级结构。
一步法扩增(one step amplification)是为了检测低丰度mRNA的表达,利用同一种缓冲液,在同一体系中加入逆转录酶、引物、Taq酶、4种dNTP直接进行mRNA反转录与PCR扩增。发现Taq酶不仅具有DNA多聚酶的作用,而且具有反转录酶活性,可利用其双重作用在同一体系中直接以mRNA为模板进行反转录和其后的PCR扩增,从而使mRNA的PCR步骤更为简化,所需样品量减少到最低限度,临床小样品的检测非常有利。用一步法扩增可检测出总RNA中小于1ng的低丰度mRNA。该法还可用于低丰度mRNA的cDNA文库的构建及特异cD-NA的克隆,并有可能与Taq酶的测序技术相组合,使得自动反转录、基因扩增与基因转录产物的测序在一个试管中进行。
十一、定量PCR
1.DNA-PCR定量用同位素标记的探针与电泳分离后的PCR扩增产物进行杂交,根据放射自显影后底片曝光强弱可以对模板DNA进行定量。Abbot等利用这种方法对人类T细胞白血病反转录基因进行了定量研究。
PCR扩增产物用专为检测ds-DNA而设计的微量荧光计定量,利用染料H33258专与双链DNA结合而使荧光增强50倍的特性。可以从标准模板系列稀释扩增产物量曲线上读出样品中模板DNA的量或拷贝数,达到PCR定量的目的。
利用倍比稀释模板作系列稀释PCR,求出最低(PCR-EB)检测限来比较,也是常用的半定量PCR方法。
2.mRNA-PCR定量由于MRNA-PCR定量需经两个酶(RT和Taq)催化,因而影响因素较多。1989年Wang等报道了低丰度mRNA绝对定量方法。利用浓度已知且与待测靶mR-NA序列相同的内对照mRNA(其片段长短不同,便于PCR扩增后产物的分离),在同一体系中,用相同的由32P标记的引物与待测mRNA一同进行逆转录和PCR扩增,扩增产物电泳后,分别测定二者产物放射性强度,由预先制备的标准曲线推算出每个样本特异mRNA的量。Gilliland等的结果表明,在1ng总RNA中可以对小于1pg的特异mRNA进行定量。这一定量方法在肿瘤、代谢失调、基因表达调控等研究中均有重要意义。
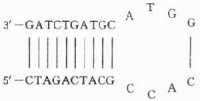
例如:假定我们要研究的DNA双链两端的序列是:TATTCGGGCTTTCCAAGCAACTAG...........GATCTATCCAACGGCTAGGCATTTATAAGCCCGAAAGGTTCGTTGATC...........CTAGATAGGTTGCCGATCCGTAAA在PCR之前,我们首先人工合成两段有20-30碱基的引物,能够分别与上下两条链的一端配对,比如一条是(为与模板能够区别,以小写表示):ataagcccgaaaggttcgtt,另一条就是tttacggatcggcaacctat。把这两段引物和DNA模板、DNA聚合酶、底物(四种脱氧核苷)混合在一起,我们就可以开始做PCR了。
第一步叫“变性”,把样品加热到94-96℃一到数分钟,让DNA模板变性变成单链。
第二步叫“退火”,让样品的温度下降到50-65℃一到数分钟,引物就可以结合到模板上去。
TATTCGGGCTTTCCAAGCAACTAG...........GATCTATCCAACGGCTAGGCATTTataagcccgaaaggttcgtttatccaacggctaggcatttATAAGCCCGAAAGGTTCGTTGATC...........CTAGATAGGTTGCCGATCCGTAAA第三步叫“延伸”,让样品的温度上升到72℃一到数分钟,DNA聚合酶就可以从引物开始用底物复制出新链。
TATTCGGGCTTTCCAAGCAACTAG...........GATCTATCCAACGGCTAGGCATTTataagcccgaaaggttcgttGATC...........CTAGATAGGTTGCCGATCCGTAAATATTCGGGCTTTCCAAGCAACTAG...........GATCtatccaacggctaggcatttATAAGCCCGAAAGGTTCGTTGATC...........CTAGATAGGTTGCCGATCCGTAAA这样经过三步一个循环,一条双链就变成了两条,再来一个循环,就变成了四条……在一个由计算机控制的循环加热器上经过三十个循环,就可以把原来的样品精确地扩增了2的30次倍,而这只需要两三个小时。PCR要成功,必须要有能够忍耐高温、在高温下仍然能有活性的DNA聚合酶。这种酶可从生活在温泉中的细菌中提取,其中最常用的一种叫Taq聚合酶。野生型的Taq聚合酶保真度较差,在复制比较长的模板时容易发生点突变。通过遗传工程,我们已获得了高保真度的Taq聚合酶,大大提高了PCR复制的精确程度。
应用
在分子生物学基础研究上,PCR被广泛地用于基因克隆和制造突变。在临床医学上,PCR被用于鉴别遗传疾病和快速检测病毒、病菌感染。用传统的方法,要检测病毒、病菌的感染需要把病原体培养数周才能鉴定,而现在用PCR,即可以迅速判断人体细胞(比如血液细胞)中是否存在病毒、病菌的DNA(比如HIV的DNA)而确诊。
在法医上,PCR目前已成为发现罪证的重要方法。比如,0.1微升的唾液痕迹所含的DNA就可以通过PCR扩增而获得足够量的DNA进行测序鉴定罪犯。毛发、血迹、唾沫、精液因此都可以成为重要的罪证。利用PCR技术,科学家们已从林肯的头发和血液、埃及的木乃伊、琥珀中八千万年前的昆虫、恐龙的骨头等不寻常的样品中提取了足够的DNA进行研究。博物馆中的化石标本都有可能成为遗传学的研究对象,一门分子古生物学因此诞生。