成体干细胞
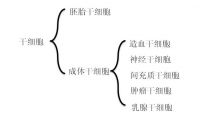
成体干细胞(Adult Stem Cell,ASCs)是存在于人与哺乳动物已分化组织与器官中,具有自我更新、高度增殖和多向分化潜能的尚未分化的不成熟细胞群体。根据干细胞所处的发育阶段分为胚胎干细胞(embryonic stem cell,ES细胞)和成体干细胞(somatic stem cell)本词条讲述成体干细胞,在适当的诱导条件下,可分化出组成该器官组织的各种细胞类型,替代生理性衰亡细胞在组织受损时起代偿性增生作用,维持机体的正常结构和功能。ASCs在体外可跨系、甚至跨胚系分化为某些成熟细胞[3]。各种ASCs在体内外生长特性和表型可能不尽一致,但在组织结构中位置相对固定,处于一个由干细胞、基底膜和调控细胞组成的微环境之中,形态学表现为细胞体积小,胞内细胞器稀少,细胞内RNA含量低。
ASCs通常处于静息状态,分裂缓慢,其分裂生长方式主要为对称分裂和非对称分裂。对称分裂形成两个相同的干细胞,非对称分裂生成一个分化细胞和一个干细胞。ASCs在损伤或血小板活化、释出组织生长因子的作用下被激活,取代失去生理活性的细胞或通过修复损伤来维持组织内环境的稳定。
成体干细胞研究的优越性
虽然胚胎干细胞(EmbryonicStemCell,ESC)几乎可向所有的成年组织分化,但由于 (1)ESC是来源于人或动物胚胎内细胞团或原始生殖嵴的一种多能细胞系,其研究受到伦理学问题和取材困难等因素的限制,而主要通过动物实验进行。 (2)ESC治疗相当于异体移植,存在免疫排斥问题。
成体干细胞与胚胎干细胞相比,在应用上有更大的优势: (1)ASCs存在于人体各种组织和器官中,来源广泛,不涉及伦理问题。 (2)正常情况下ASCs处于静止状态,只有在病理情况下才显示出一定的自我更新潜能,其导致细胞“永生化”甚至癌变的可能性较小。 (3)ASCs可产生一个含有多种细胞成分的特定组织,移植入患者体内后,有望产生该器官所有类型的细胞,达到在结构和功能上的完美修复或替代。 (4)一些类型的ASCs可向体内损伤甚至远离其发源地的部位迁移,成为前体细胞并分化为终末成熟细胞,用来修复组织损伤。也可将其作为目的基因的理想载体。 (5)某些ASCs可分泌生长因子,发挥动员或保护该组织其他细胞的作用以加强移植效果。人们可以利用基因工程手段对ASCs进行操作,以补充患者组织中缺乏的某些成分。
成体干细胞的分类
目前发现的ASCs主要有造血干细胞、间充质干细胞、神经干细胞、表皮干细胞、骨骼肌干细胞、脂肪干细胞、胰干细胞、眼角膜干细胞、肝脏干细胞以及肠上皮干细胞等。
造血干细胞
造血干细胞(HSC)在胚胎的早期就已出现,源于主动脉旁-胚脏壁和主动脉-性腺-中肾区,逐渐移植到卵黄囊、肝脏、脾脏及骨髓。HSC存在于骨髓、外周血、脐带血中,在不同的细胞因子作用下在体外扩增及向红系、粒系、巨核系等不同血细胞定向分化。应用PDGF体外扩增CD34造血干细胞和CD41的巨核细胞已取得较为满意的结果。HSC可分化成心肌细胞、骨骼肌细胞、肝细胞、血管内皮细胞以及分化为肺泡、支气管、胃、肠、肾小球、皮肤等细胞。
间充质干细胞
成人的间充质干细胞(MSCs)主要来源于骨髓,不表达造血干细胞表面抗原CD34、CD14及白细胞表面抗原CD45,而表达SH2、SH3、CD29、CD106和CD166等表面抗原。PDGF作为结缔组织生长因子,对体外MSCs生长有促进作用。在合适的条件下,MSCs易诱导分化为间充质组织细胞如成骨细胞,也可分化为肝细胞、肌细胞、脂肪细胞、软骨细胞、成骨细胞、神经细胞、成纤维细胞、上皮细胞、造血干细胞和基质细胞,在一定条件下可形成肌小管和肌腱。
神经干细胞
神经干细胞(NeuralStemCell,NSC)分布于成人及胚胎的中枢神经及周围神经,其特征性抗原为神经巢蛋白。NSC可分化为不同类型的神经元、星型胶质细胞和少突胶质细胞,并表现相应的形态学和电生理学的能力。中枢神经细胞可分化为血细胞。
表皮干细胞
皮肤皮脂腺开口处与立毛肌毛囊附着处之间的毛囊外根鞘处含有丰富的干细胞。可用于自体和异体移植治疗重度烧伤、慢性溃疡等。从鼠皮肤分离获得的干细胞可转化为神经元细胞、神经胶质细胞、平滑肌细胞和脂肪细胞等。
其他干细胞
骨骼肌干细胞可用于修复骨缺损等,也可分化为血细胞。脂肪组织中含有的ASCs可在体外被诱导分化为神经细胞、肌细胞、成骨细胞等。胰干细胞可在体外诱导培养为胰岛素分泌细胞。有研究发现用自体眼角膜缘干细胞培养后形成的细胞层移植到患眼角膜表面,成功实现眼表面重建。肠上皮干细胞在促进肠道损伤后结构与功能的完全修复上意义重大。肝脏干细胞在肝功能重建、干细胞癌治疗以及基因治疗方面有诱人的前景。
成体干细胞可能的临床应用
(1)组织损害类疾病:将ASCs直接移植给患者,如骨髓移植治疗白血病,已获一定疗效。将ASCs注入冠状动脉,能加速改变心肌梗死后斑痕的厚度和大小。将干细胞注入骨骼肌能够修复皮肤、角膜、肌腱、韧带、关节盘和其他结缔组织等。干细胞经神经生长因子处理后能形成神经样细胞,表达神经胶质酸性蛋白,促进中枢和外周神经组织的再生与修复,也可治疗脑卒中。
(2)活性因子缺乏性疾病:将经过定向分化或基因修饰后的干细胞进行筛选,把合格的细胞移植给病人,这两种方法都属于细胞替代,用于糖尿病、帕金森病等多种活性因子缺乏性疾病。
(3)器官替代:干细胞技术的理想阶段就是在体外进行器官克隆以供病人移植。与组织工程技术相结合,干细胞替代治疗的最终目的是利用患者自己的干细胞来制造替代器官,如皮肤、肝脏以及肾脏等。
(4)肿瘤发生机制的研究:已发现一种新的基因信号能阻止或允许干细胞发展成特定的细胞类型。这可能导致新的干细胞疗法,有助于癌症的研究。
(5)延缓衰老方面的应用:潘基因家族既可决定细胞类型,又可控制分化。了解该基因的调控对延缓衰老、增长人类寿命可能意义重大。
综上所述,ASCs及其衍生器官的临床广泛应用必将导致一次医学革命,产生一次全新的治疗技术。但应注意到,目前多数试验结果来自动物体内实验,许多是群体细胞研究,并未在克隆细胞水平得到证实。人ASCs的特性是否与动物一致,体外结果是否与体内结果一致尚不清楚。更重要的是ASCs的分化潜能到底有多大,分化的具体分子机制还不十分清楚。并且ASCs在临床应用还存在体外分离、扩增、诱导及移植后增殖调控等技术问题。但是,这些基本问题的深入探索无疑会使ASCs在未来的细胞和组织工程应用中具有广阔前景。可以预见,对干细胞可塑性的逐步阐明将把我们带入一个医学新纪元。
参看
参考
郭虹赵春华.成体干细胞及其可塑性的研究进展.《细胞生物学杂志》 ISTIC -2003年3期